

TRABAJO LIBRE: Poster
Jorge Rubio Poblete, Juan Henríquez, Paola García-Huidobro, Yael Díaz, Zacarias Ruiz, Katia Fernández, Julieta Aránguiz
El virus del papiloma humano de alto riesgo (VPH-AR) es el principal agente etiológico del cáncer cervicouterino. La detección molecular de su ADN se ha consolidado como una herramienta fundamental tanto en el tamizaje primario como en el manejo de anormalidades citológicas. En este contexto, se evaluó el desempeño de un nuevo ensayo comercial, "HUMAN PAPILLOMAVIRUS NUCLEIC ACID AMPLIFICATION TEST KIT" (MOSPIRE), una prueba de qPCR multiplex que reporta tres categorías: HPV16, HPV18 y "otros VPH-AR". El estudio se realizó siguiendo los lineamientos de la guía CLSI EP12-A2, comparando el ensayo contra el método de referencia Anyplex™ II HPV HR (Seegene), capaz de identificar 14 genotipos de VPH-AR de forma individual.
El objetivo general fue verificar el desempeño analítico y estimar la concordancia clínica del kit MOSPIRE respecto al método de referencia para respaldar su implementación en la rutina del laboratorio.
Los objetivos específicos fueron:
Se realizó un estudio con dos componentes: una verificación analítica y un estudio de concordancia clínica.
Para la verificación analítica, se utilizó un panel de controles comerciales (AmpliRun®, Vircell) compuesto por 10 controles positivos de ADN genómico para VPH 16 y 18, y 11 controles negativos de ADN genómico de virus herpes simplex 1/2 (VHS) y varicela-zóster (VZV).
Para el estudio de concordancia, se analizó un conjunto de 14 muestras clínicas previamente positivas por el método de referencia, de las cuales 12 eran endocervicales y 2 biopsias (anal y cervical). Todas las muestras clínicas fueron sometidas a una dilución 1:3 con PBS antes del análisis con el kit MOSPIRE. El procesamiento de muestras formó parte de la extensión del “Plan piloto para la pesquisa de VPH bucal”, aprobado por el comité de ética FACSYO UDP.
El ensayo MOSPIRE y el de referencia (Seegene) se procesaron en el termociclador Bio-Rad CFX96 IVD. Una muestra clínica fue clasificada como inválida tras fallar la amplificación del control interno en dos ocasiones, siendo excluida del análisis principal, que se realizó sobre 13 muestras válidas. El análisis estadístico se basó en la guía CLSI EP12-A2, calculando el PPA como métrica principal, debido a la ausencia de muestras clínicas negativas.
En la verificación analítica, el kit MOSPIRE demostró un desempeño excelente, alcanzando una sensibilidad del 100% (10/10) al detectar correctamente todos los controles positivos, y una especificidad del 100% (11/11) al resultar no reactivo en todos los controles negativos.
En el estudio de concordancia clínica con 13 muestras válidas, el PPA por muestra fue de 92,31% (12/13). Al analizar la concordancia por genotipo (considerando las múltiples infecciones), el PPA fue de 87,50% (14/16 detecciones). La concordancia global, incluyendo tanto muestras clínicas como controles, fue de 95,83% a nivel de muestra (23/24) y 92,86% a nivel de genotipo (26/28).
Se registraron dos genotipos positivos por el método de referencia que no fueron detectados por MOSPIRE. Estas discordancias correspondieron a muestras con baja carga viral según el método de referencia y se atribuyeron al efecto combinado de la dilución preanalítica y una posible degradación del ADN. No se documentaron resultados falsos positivos.
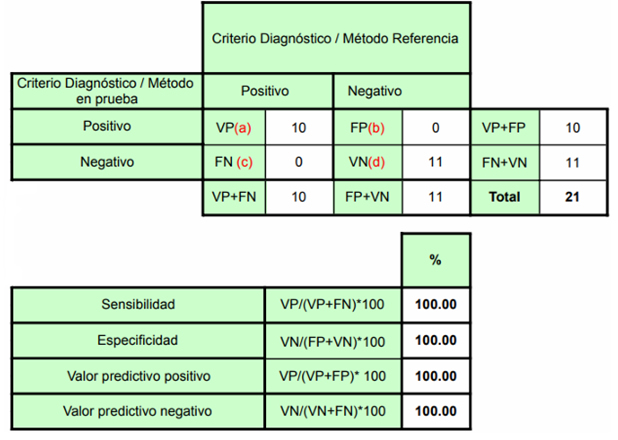
Figura 1. Tablas de contingencia para concordancia por muestra (No válido = 13).
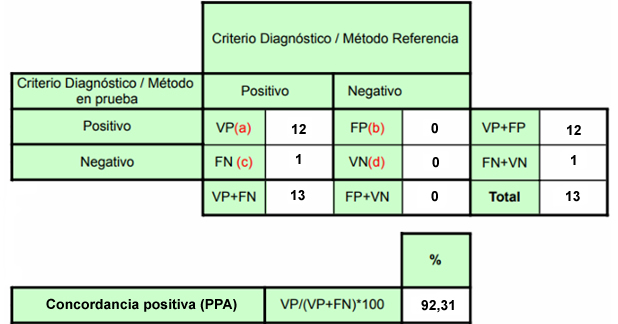
Figura 2. Tablas de contingencia para verificación de técnica MOSPIRE.
El kit MOSPIRE demostró un desempeño analítico óptimo, con una exactitud diagnóstica del 100% en el protocolo de verificación. La concordancia clínica con el método de referencia fue alta, tanto a nivel de muestra como de genotipo. Las discordancias observadas fueron escasas y se asociaron a factores preanalíticos (dilución y calidad de la muestra), y no a un fallo sistemático del ensayo. Los resultados respaldan que el kit MOSPIRE es apto para su implementación en el laboratorio para la detección de VPHAR. Se recomienda realizar estudios futuros con un mayor número de muestras, incluyendo negativos clínicos y diferentes cargas virales.

Revista de Resúmenes de Trabajos Libres - Noviembre 2025
VI Congreso de la Sociedad Médica de Laboratorio Clínico de Chile - SMLC
Primer autor: Jorge Rubio Poblete
Co-autores
Juan Henríquez, Paola García-Huidobro, Yael Díaz, Zacarias Ruiz, Katia Fernández, Julieta Aránguiz
Instituciones a las que representa el trabajo: Inmunocel, PROLAB, Escuela de Tecnología Médica Universidad del Desarrollo, Escuela de Tecnología Médica y Obstetricia Universidad Diego Portales
Nombre del relator: Jorge Rubio Poblete
E-mail: jorgerubio@ug.uchile.cl
Teléfono: (56) 973-918410
País al que representa: CHILE
Categoría a la que postula: Microbiología y parasitología
Recibido: 01 / Mayo / 2025
Introducción del autor