


Catalina Flores-Maldonado, Enoc Mariano Cortés-Malagón, Rafael García-Rascón, Julia Dolores Toscano-Garibay, Gerardo Rubén Contreras, Juan Manuel Gallardo, Carmen Palacios-Reyes, José Bonilla-Delgado*
La infección por virus del papiloma humano de alto riesgo es el principal agente causal de neoplasias y cáncer cervical. Elucidar los mecanismos que subyacen a la carcinogénesis cervical permitirá el avance de nuevas vacunas, así como el descubrimiento de biomarcadores diagnósticos y terapéuticos. En este sentido, los modelos murinos utilizados en investigación básica son una herramienta invaluable, tanto para el uso de nuevos agentes terapéuticos, así como la caracterización de nuevas vías de señalización poco descritas que sean relevantes durante el proceso carcinogénico. En la presente revisión, exploramos los modelos preclínicos actuales y enfatizamos las fortalezas y debilidades de estos modelos para brindar actualizaciones sobre nuevas oportunidades para investigar las muchas incógnitas que quedan en la investigación del cáncer cervicouterino.
High-risk human papillomavirus infection is the primary causal agent of neoplasia and cervical cancer. Elucidating the mechanisms underlying cervical carcinogenesis will allow the advancement of new vaccines and the discovery of diagnostic and therapeutic biomarkers. In this sense, murine models used in basic research are an invaluable tool, both for the use of new therapeutic agents and the characterization of new, poorly described signaling pathways that are relevant during the carcinogenic process. In the present review, we explore current preclinical models, emphasizing the strengths and weaknesses of these models to provide updates on new opportunities to investigate the many remaining unknowns in cervical cancer research.
Según el Observatorio Mundial del Cáncer (GLOBOCAN), en su última edición de 2022, el cáncer de cervicouterino (CC) es el cuarto cáncer más común, y es la tercera causa de mortalidad por cáncer entre las mujeres. En países desarrollados como Estados Unidos, la implementación de programas de detección, y el acceso a vacunas, han reducido su puesto al duodécimo en términos de tasas de incidencia y mortalidad. Sin embargo, en países en vías de desarrollo, como México, el CC ocupa el segundo lugar en incidencia y mortalidad.1,2
La infección por virus del papiloma humano de alto riesgo (HR-HPVs) es el principal factor etiológico del CC. Los HPVs constituyen una basta familia de virus de DNA de cadena doble que pueden causar lesiones neoplásicas en piel, así como en mucosas mono- y multi-estratificadas.3 Aunque las neoplasias del cuello uterino causadas por el HPV tipo 16 (HPV16) son las lesiones de mayor interés clínico, actualmente existe una creciente tendencia hacia los cánceres orales, y, aunque a la fecha existen dos vacunas profilácticas contra el HPV16, la validación final de su eficacia contra lesiones orales, así como su efectividad cruzada contra otros genotipos de HPV de alto riesgo, requerirá una extensa recopilación de datos durante décadas.4
La infección por HR-HPVs ocurre de manera natural en muchas especies de mamíferos, aunque también se han podido infectar de manera inducida, o mediante la introducción de construcciones génicas por transgénesis. Gracias a ello, en la actualidad contamos con distintos modelos murinos que han servido no solo como modelos preclínicos de laboratorio, sino también como modelos que emulan la carcinogénesis cervical humana.5 En concreto, se han estudiado los virus del papiloma humano de roedores, lagomorfos, caninos, bovinos y equinos como modelos de la enfermedad por HPV, lo que ha contribuido a la investigación sobre el diagnóstico, el tratamiento, e incluso la evaluación de vacunas.6 Se están desarrollando nuevos modelos animales utilizando ratones de laboratorio que siguen mejorando nuestra comprensión de las infecciones de las mucosas en sitios clínicamente importantes.
Modelos murinos transgénicos
Los primeros modelos de ratón transgénico consistieron en la expresión de la región temprana del papilomavirus bovino (BPV-1) y los papilomavirus humanos cutáneos, HPV-5, y HPV-18; estos modelos fueron capaces no solo de formar lesiones cutáneas, sino también amplificar su construcción viral.7,8 Posteriormente, se han investigado exhaustivamente numerosos modelos de ratones transgénicos que expresan oncogenes virales de HPV en tejidos de cérvix y piel bajo el control de la citoqueratina 14 humana (K14).9-12 De estos modelos, han surgido hallazgos significativos con respecto a los efectos de los oncogenes virales in vivo, particularmente en ubicaciones anatómicas cruciales como el cuello uterino y el epitelio anal.9
Jeffrey M. Arbeit, M.D., de la Universidad de California-San Francisco, empleó los modelos murinos con construcciones expresadas bajo el control de K14, y presentó importantes estudios con este tipo de modelos para evaluar el impacto del HPV y los estrógenos para desarrollar CC. El modelo de su equipo de investigación, ratones transgénicos K14-HPV16, implica la expresión de toda la región temprana de HPV16 en los queratinocitos basales del epitelio escamoso a través del casete de expresión de queratina-14 humana. El ochenta por ciento de estos ratones experimentan cánceres de piel espontáneos entre los 8 y 12 meses de edad, pero no muestran carcinogénesis cervical por sí solos.13
Para iniciar la carcinogénesis cervical, a ratones transgénicos hembra de 1 mes de edad, se les administran pellets de liberación continua que contienen 17-B-estradiol a intervalos de 2 meses durante un máximo de 6 meses. Los ratones transgénicos desarrollan lesiones similares a la neoplasia intraepitelial cervical 1 (NIC-1) después de 1 mes, y progresan a lesiones similares a NIC-3 a los 3 meses y evolucionan a carcinoma in situ o cánceres invasivos a los 4 meses de tratamiento. Los cánceres invasivos aparecen en la vulva, la vagina, el cuello uterino externo y en la zona de transformación cervical, ubicada en el canal cervical superior cerca de la inserción de cada cuerno uterino en ratones.
La reducción gradual de la dosis de estrógeno identificó un nivel más bajo de estrógeno que afecta preferentemente la carcinogénesis de la zona de transformación. Investigaciones adicionales establecieron que el gen E7 es el más importante y adecuado para la neoplasia inducida por estrógenos.13
En estudios con ratones con el marco de lectura abierto E7 (ratones K14-E7), los investigadores descubrieron que la proliferación del epitelio escamoso cervical era de 2 a 3 veces mayor que en ratones que portaban solo el gen E6 o en ratones no transgénicos. La relación entre el estrógeno y el desarrollo del cáncer de cuello uterino varió, dependiendo de la cepa de ratón utilizada. Algunas cepas mostraron una mayor susceptibilidad a la carcinogénesis en comparación con otras. Estos hallazgos respaldan la investigación epidemiológica que sugiere una variación en la tasa de infección por HPV y el desarrollo de lesiones cervicales en mujeres que toman anticonceptivos orales, como observaron tanto Franco como Herrero.14
Los ratones transgénicos K14E7 tratados con estrógenos han sido ampliamente utilizados en nuestro laboratorio, y han emulado muchos de los biomarcadores ya descritos en pacientes tales como: p16, MCM-2 -7, Ki67, PCNA; pero de manera novedosa, B-catenina y Cldn-4.15,16 La vía de B-catenina está poco entendida en CC, pero se ha descrito posteriormente en pacientes, y se ha demostrado que tiene especial importancia en lesiones malignas cervicales.17,18 A continuación, se muestra un ejemplo del tipo de lesión en tejido ectocervical que generar este tipo de modelos, la imagen muestra una lesión de bajo grado y al marcador PCNA como biomarcador de células inmaduras.
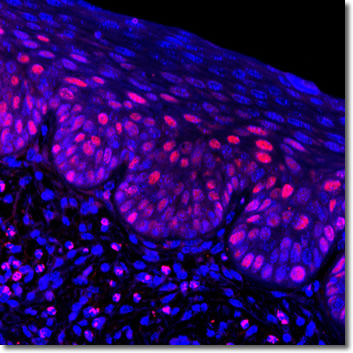
FIGURA 1: Lesión ectocervical generada por un tratamiento estrogénico 17-B-Estradiol 0.05 mg/mes en el modelo murino K14E7.
Modelos murinos avatar
Los modelos de ratón con trasplante de tumor, o avatar, se han utilizado para evaluar diversas estrategias inmunoterapéuticas destinadas a curar enfermedades y cánceres relacionados con el HPV.19 Los primeros modelos de trasplante de tumor, consistieron en inocular en el dorso de ratones líneas celulares que expresan diferentes oncogenes virales del VPH para explorar métodos mejorados de presentación de antígenos20, comprender la función de las células T CD8 en el manejo de tumores20,21, evaluar inhibidores de puntos de control que reducen el agotamiento de las células T22,23 y aumentar la efectividad de las vacunas.24-26
Los modelos de xenoinjerto de ratón fueron el enfoque experimental pionero para cultivar cepas de HPV en un entorno de laboratorio.27 Genotipos de HPV como 11, 16, 40, 83 y 6 se cultivaron de manera exitosa en xenoinjertos de prepucio humano en el dorso de ratones atímicos y SCID Severe Combined Inmmunodeficiencie Disease.28-30 Además, se obtuvieron conocimientos clave sobre el tropismo tisular de HPV11 utilizando muestras de tejido de varios sitios anatómicos. En los últimos tiempos, estos modelos han sido poco estudiados, probablemente debido a avances como los sistemas de cultivo en balsas organotípicas31, o las tecnologías de pseudovirus.32,33 Sin embargo, siguen siendo importantes para estudiar el tropismo viral y producir grandes cantidades de viriones nativos para el análisis estructural.
Los modelos animales de CC son valiosos recursos in vivo para avanzar en la comprensión de los principios fundamentales de la biología del HPV. Las limitaciones específicas de los tejidos y las especies, junto con la estrecha relación entre la diferenciación de los queratinocitos y el ciclo de vida viral, aún requieren de una mayor exploración a nivel molecular y celular. Para comprender plenamente el papel de los factores de restricción virales del huésped y la inmunidad innata, es esencial la investigación en curso utilizando modelos preclínicos de papilomavirus manipulables genéticamente.
Reconocimientos
Los autores desean agradecer al Dr. Patricio Gariglio por sus aportaciones críticas al manuscrito.

Catalina Flores-Maldonado
Gerardo Rubén Contreras
Departamento de Fisiología, Biofísica y Neurociencias. Centro de Investigación y Estudios Avanzados (Cinvestav). Ciudad de México 07360. México.
Enoc Mariano Cortés-Malagón
División de Investigación. Hospital Juárez de México. Ciudad de México 07760. México; Laboratorio de Genética. Hospital Nacional Homeopático. Ciudad de México 06800, México.
José Bonilla-Delgado*
Rafael García-Rascón
Julia Dolores Toscano-Gariba
Unidad de Investigación. Hospital Regional de Alta Especialidad de Ixtapaluca. IMSS-Bienestar. Ixtapaluca 56530, México.
Juan Manuel Gallardo
Unidad de Investigación Médica en Enfermedades Nefrológicas. Hospital de Especialidades, Centro Médico Nacional Siglo XXI. Instituto Mexicano del Seguro Social. Ciudad de México 06720. México.
Carmen Palacios-Reyes
Departamento de Ciencias Médicas. División de Ciencias de la Salud. Universidad de Guanajuato, Campus León. Guanajuato 37000, México.
CONTACTO
José Bonilla-Delgado.
Hospital Regional de Alta Especialidad de Ixtapaluca. IMSS-Bienestar Carr. Federal México-Puebla Km. 34.5, 56530, Ixtapaluca, EDOMEX, México.
Reconocimientos: Los autores desean agradecer al Dr. Patricio Gariglio por sus aportaciones críticas al manuscrito.
Dr. José Bonilla-Delgado